SEBA Class 10 Science Chapter 1 – ৰাসায়নিক বিক্ৰিয়া আৰু সমীকৰণ Solutions & Summary
Need complete solutions for Class 10 Science Chapter 1 – “ৰাসায়নিক বিক্ৰিয়া আৰু সমীকৰণ” (Chemical Reactions and Equations)? Ospin Academy offers detailed NCERT solutions for SEBA Assam (Assamese Medium) students.
📖 Chapter Overview:
This chapter explains the fundamental concepts of chemical reactions and equations, including their types, balancing methods, and real-life applications. It is an essential chapter for SEBA Class 10 Science (Assamese Medium) students.
📌 Key Topics Covered:
- Introduction to Chemical Reactions
- Types of Chemical Reactions (Combination, Decomposition, Displacement, and Double Displacement)
- Balancing Chemical Equations
- Oxidation and Reduction Reactions
- Corrosion and Rancidity
📌 Important Questions for Exams:
- What is a chemical reaction? Explain with an example.
- Describe the different types of chemical reactions with suitable examples.
- What is the significance of balancing a chemical equation?
- Explain oxidation and reduction with real-life examples.
- What are corrosion and rancidity? How can they be prevented?
📝 How Ospin Academy Helps:
- Detailed Step-by-Step NCERT Solutions for SEBA (Assamese Medium)
- Clear Explanations of Complex Concepts with Examples
- Quick Revision Notes for Exam Preparation
- MCQs and Important Questions with Answers
Get the most accurate and detailed solutions for SEBA Class 10 Science Chapter 1 – “ৰাসায়নিক বিক্ৰিয়া আৰু সমীকৰণ” (Chemical Reactions and Equations) at Ospin Academy.
Class 10 Science (বিজ্ঞান) PDF Solutions 2025-26 | SEBA Assam
Download Class 10 Science (বিজ্ঞান) PDF with MCQs, textbook solutions, and additional practice questions for SEBA Assam 2025-26.
Textbook – Page 6
প্ৰ শ্না ৱ লী
1. বায়ুত দহনৰ আগতে মেগনেছিযামৰ ফিটা এডাল পৰিস্কাৰ কৰি ল’ব লাগে কিয় ?
উত্তৰ: মেগনেছিয়ামৰ ফিটা এডালৰ ওপৰত মেগনেচিয়াম অক্সাইড (MgO) ৰ তৰফ থাকে যিয়ে পুনৰ অক্সিজেনৰ লগত বিক্ৰিয়া কৰাত বাধা দিয়ে । সেয়েহে বায়ুত দহনৰ আগতে মেগনেছিয়ামৰ ফিটা এডাল পৰিস্কাৰ কৰি ল’ব লাগে।
2. তলৰ ৰাসায়নিক বিক্ৰিয়াবোৰৰ বাবে সন্তুলিত সমীকৰণ লিখা ।
(i) হাইড্ৰ’জেন + ক্ল’ৰিন → হাইড্ৰজেন ক্লৰাইড
(ii) বেৰিয়াম ক্ল’ৰাইড + এলুমিনিয়াম ছালফেট → বেৰিয়াম ছালফেট + এলুমিনিয়াম ক্ল’ৰাইড
(iii) ছ’ডিয়াম + পানী → ছ’ডিয়াম হাইড্ৰ’ক্সাইড +হাইড্ৰ’জেন
উত্তৰ : (i) H2 + Cl2 → 2HCl
(ii) 3BaCl2 + Al2(SO4)3 → 3BaSO4 + 2AlCl3
(iii) 2Na + 2H2O → 2NaOH + H2
3. তলৰ বিক্ৰিয়াবোৰৰ বাবে অৱস্থা চিহ্ন ( State Symbols) সহ একোটা সন্তুলিত ৰাসায়নিক সমীকৰণ লিখা ।
(i) বেৰিয়াম ক্ল’ৰাইড আৰু ছ’ডিয়াম ছালফেটৰ জলীয় দ্ৰৱৰ মাজত বিক্ৰিয়া ঘটি অদ্ৰাৱ্য বেৰিয়াম ছালফেট আৰু ছ’ডিয়াম ক্ল’ৰাইডৰ দ্ৰৱ প্ৰস্তত হয় ।
(ii) ছ’ডিয়াম হাইড্ৰ’ক্সাইড দ্ৰৱ (পানীত) হাইড্ৰ’ক্ল’ৰিক এছিডৰ (পানীত)ৰে সৈতে বিক্ৰিয়া কৰি ছ’ডিয়াম ক্ল’ৰাইডৰ দ্ৰৱ আৰু পানী উৎপন্ন কৰে ।
উত্তৰ:
(i) BaCl2 + (aq) + Na2SO4 → BaSO4 (S) + 2NaCl (aq)
(ii) 2NaOH (aq) +2HCl (aq) →2NaCl (aq) + H2O (l)
Textbook – Page no 10
1. এটা পদাৰ্থ ‘X’ দ্ৰৱক বগা ৰঙ সানিবলৈ (White washing) ব্যৱহাৰ কৰা হয় ।
(i) পদাৰ্থ ‘X’ ৰ নাম আৰু সংকেত লিখা ।
(ii) পানীৰে সৈতে পদাৰ্থ ‘X’ এ কৰা বিক্ৰিয়াটো লিখা ।
উত্তৰ: (i) পদাৰ্থ ‘X’ ৰ নাম : কেলছিয়াম অক্সাইড
সংকেত : CaO
(ii) পানীৰে সৈতে পদাৰ্থ ‘X’ এ কৰা বিক্ৰিয়াটো হ’ল –

2. কাৰ্যকলাপ 1.7 ত এটা পৰীক্ষানলত , সংগ্ৰহ কৰা গেছৰ পৰিমানণ আনটো পৰীক্ষানলত সংগ্ৰহ কৰা পৰিমানণ দূগুণ কিয় ? এই গেছটোৰ নাম লিখা ।
উত্তৰ :

ইয়াত ,
উৎপন্ন হোৱা হাইড্ৰ’জেন গেছৰ আয়তন অক্সিজেন গেছৰ দূগুণ । সেইবাবে এটা পৰীক্ষানলীত সংগ্ৰহ কৰা গেছৰ পৰিমাণ আনটো পৰীক্ষানলত সংগ্ৰহ কৰা পৰিমানণ দূগুণ ।
গেছটোৰ নাম : অক্সিজেন আৰু হাইড্ৰ’জেন ।
Textbook – Page no 13
1.লোৰ গজাল এটা ডুবাই ৰাখিলে ক’পাৰ ছালফেটৰ দ্ৰৱ এটাৰ ৰঙৰ পৰিৱৰ্বতন ঘটে কিয় ?
উত্তৰ: লো কপাৰতকৈ অধিক সক্ৰিয় গতিকে লোৱে ক’পাৰ ছালফেট দ্ৰৱ ক’পাৰ মৌলটোক অপসাৰিত কৰি আইৰণ ছালফেট উৎপন্ন কৰিছে । সেইবাবে দ্ৰৱটোৰ ৰঙৰ পৰিৱৰ্তন কৰিছে ।
এই বিক্ৰিয়াটোৰ ৰাসায়নিক হ’ব –
Fe (S) + CuSo4 (aq) → FeSo4 (aq) + Cu (S)
2. কাৰ্যকলাপ 1.10 ত দিয়া বিক্ৰিয়াটোৰ বাহিৰে আন এটা দ্বিঅপসৰন বিক্ৰিয়াৰ উদাহৰণ দিয়া ।
উত্তৰ: 2Cu + O2 → 2CuO
3. তলৰ বিক্ৰিয়া কেইটাত জাৰিত আৰু বিজাৰিত হোৱা পদাৰ্থসমূহ বাচি উলিওৱা
(i) 4Na (S) + O2 (g) → 2Na2 O(S)
(ii) CuO (S) + H2 (g) → Cu (S) + H2O (l)
উত্তৰ:
(i) 4Na (S) + O2 (g) → 2Na2O(S) → Na জাৰিত হৈ Na2O উৎপন্ন হৈছে ।
(ii) CuO (S) + H2 (g) →Cu (S)+ H2O(l) → CuO(S) বিজাৰণ হৈ Cu উৎপন্ন হৈছে আৰু H2 জাৰণ হৈ H2O উৎপন্ন হৈছে ।
(অনুশীলনী)
1. তলৰ বিক্ৰিয়াটোৰ বাবে উক্তিসমূহৰ কোনকেইটা অশুদ্ধ ?
2PbO (S) + C (S) → 2Pb (S) + CO2 (g)
(a) লেড বিজাৰিত হৈছে ।
(b) কাৰ্বন ডাই অক্সাইড জাৰিত হৈছে ।
(c) কাৰ্বন জাৰিত হৈছে ।
(d) লেড অক্সাইড বিজাৰিত হৈছে ।
(i) (a) আৰু (b)
(ii) (a) আৰু (c)
(iii) (a) , (b) আৰু (c)
(iv) সকলো
উত্তৰ: (i) (a) আৰু (b)
2. Fe2O3 + 2Al → Al2O3 + 2Fe
ওপৰতৰ বিক্ৰিয়াটো এটা উদাহৰণ
(a) এটা সংযোজন বিক্ৰিয়াৰ
(b) এটা দ্বিঅপসৰণ বিক্ৰিয়াৰ
(c) এটা বিযোজন বিক্ৰিয়াৰ
(d) এটা অপসৰণ বিক্ৰিয়াৰ
উত্তৰ: (d) এটা অপসৰণ বিক্ৰিয়াৰ
3. কি ঘটে যেতিয়া লঘু হাইড্ৰ’ক্লৰিক এছিড লোৰ গুৰিত যোগ কৰা হয় ? শুদ্ধ উত্তৰটো টিক চিন দিয়া ।
(a) হাইড্ৰজেন গেছ আৰু আইৰণ ক্ল’ৰাইড উৎপন্ন হয় ।
(b) ক্ল’ৰিন গেছ আৰু আইৰণ হাইড্ৰ’ক্সাইড উৎপন্ন হয় ।
(c) বিক্ৰিয়া নঘটে ।
(d) আইৰণ লৱণ আৰু পানী উৎপন্ন হয় ।
উত্তৰ: (a) হাইড্ৰজেন গেছ আৰু আইৰণ ক্ল’ৰাইড উৎপন্ন হয় ।
4. সন্তুলিত ৰাসায়নিক সমীকৰণ কি ? ৰাসায়নিক সমীকৰণসমূহ কিয় সন্তুলিত কৰিব লাগে ?
উত্তৰ: সন্তুলিত ৰাসায়নিক সমীকৰণ হৈছে এনে এটা ৰাসায়নিক সমীকৰণ য’ত বিক্ৰিয়ক আৰু বিক্ৰিয়জাত পদাৰ্থৰ প্ৰতিটো উপাদান মৌলৰ সমান সংখ্যক পৰমানু থাকে ।
ভৰৰ নিত্যতা বিধি অনুসৰি “ৰাসায়নিক বিক্ৰিয়া এটাত ভৰৰ সৃষ্টি বা নাশ হ’ব নোৱাৰে । সেয়েহে ভৰৰ নিত্যতা বিধি অনুসৰি ৰাসায়নিক সমীকৰণ সন্তুলিত হোৱাৰ প্ৰয়োজন ।
5. তলৰ উক্তিসমূহৰ ৰাসায়নিক সমীকৰণৰ ৰূপত লিখা আৰু সন্তুলন কৰা ।
(a) হাইড্ৰ’জেন গেছে নাইট্ৰ’জেনেৰে সৈতে লগ হৈ এম’নিয়া প্ৰস্তত কৰে ।
উত্তৰ: H2 + N2 → NH3
সমতুল ৰাসায়নিক সমীকৰণ
3H2 (g) + N2 → 2NH3 (g)
(b) হাইড্ৰ’জেন ছালফাইডে বায়ুত দাহিত হৈ পানী আৰু ছালফাৰ ডাই অক্সাইড উৎপন্ন কৰে।
উত্তৰ: H2S + O2 → H2O + SO2
সমতুল ৰাসায়নিক সমীকৰণ
2H2S (g) + 3O2 → 2H2O (l) + 2SO2 (g)
(c) বেৰিয়াম ক্ল’ৰাইডে এলুমিয়াম ছালফেটেৰে সৈতে বিক্ৰিয়া কৰি এলুমিয়াম ক্ল’ৰাইড আৰু বেৰিয়াম ছালফেটৰ অধ:ক্ষেপ উৎপন্ন কৰে ।
উত্তৰ: BaCl2 + Al2(SO4)3 → BaSO4 + AlCl3
সমতুল ৰাসায়নিক সমীকৰণ
3BaCl2 (aq) + Al2(SO4)3 (aq) → 3BaSO4 (s) + 2AlCl3 (aq)
(d) পটেছিয়াম ধাতুয়ে পানীৰে সৈতে বিক্ৰিয়া কৰি পটেছিয়াম হাইড্ৰ’ক্সাইড আৰু হাইড্ৰ’জেন গেছে উৎপন্ন কৰে ।
উত্তৰ: K + H2O → KOH + H2
সমতুল ৰাসায়নিক সমীকৰণ
2K (s) + 2H2O → 2KOH (aq) + H2 (g)
6. তলৰ ৰাসায়নিক সমীকৰণসমূহ সন্তুলন কৰা ।
(a) HNO3 + Ca (OH)2 → Ca (NO3)2 + H2 O
উত্তৰ: 2HNO3 + Ca (OH)2 → Ca (NO3)2 + 2H2O
(a) NaOH + H2SO4 → Na2SO4 + H2O
উত্তৰ: 2NaOH + H2SO4 → Na2SO4 + H2O
(c) NaCl + AgNO3 → AgCl + NaNO3
উত্তৰ: NaCl + AgNO3 → AgCl + NaNO3
(d) BaCl2 + H2SO4 → BaSO4 + HCl
উত্তৰ: BaCl2 + H2SO4 → BaSO4 + 2HCl
7. তলৰ বিক্ৰিয়াবোৰৰ বাবে সন্তুলিত ৰাসায়নিক সমীকৰণবোৰ লিখা ।
(a) কেলছিয়াম হাইড্ৰ’ক্সাইড + কাৰ্বন ডাই অক্সাইড → কেলছিয়াম কাৰ্বনেট + পানী ।
উত্তৰ: Ca(OH)2 (aq) + CO2 (g) → CaCO3 (aq) + H2O (l)
(b) যিংক + ছিলভাৰ নাইট্ৰেট → যিংক নাইট্ৰেট + ছিলভাৰ ।
উত্তৰ: Zn (s) + 2AgNO3 (aq) → Zn(NO3)2 (aq) + 2Ag (s)
(c) এলুমিনিয়াম + ক’পাৰ ক্ল’ৰাইড → এলুমিনিয়াম ক্ল’ৰাইড + ক’পাৰ ।
উত্তৰ: 2Al (s) + 3CuCl2 (aq) → 2AlCl3 (aq) + 3Cu (s)
(d) বেৰিয়াম ক্ল’ৰাইড + পটেছিয়াম ছালফেট → বেৰিয়াম ছালফেট + পটেছিয়াম ক্ল’ৰাইড ।
উত্তৰ: BaCl2 (s) + K2SO4 (aq) → BaSO4 (aq) + 2KCl (s)
8. তলত দিয়াবোৰৰ বাবে সন্তুলিত ৰাসায়নিক সমীকৰণ লিখা আৰু প্ৰতিটো কোন প্ৰকাৰৰ বিক্ৰিয়া চিনাক্ত কৰা ।
(a) পটেছিয়াম ব্ৰ’মাইড (aq) + বেৰিয়াম আয়’ডাইড (aq) → পটেছিয়াম আয়’ডাইড (aq) + বেৰিয়াম ব্ৰ’মাইড (S)
(c) যিংক কাৰ্বনেট (S) → যিংক অক্সাইড (S) + কাৰ্বন ডাই অক্সাইড (g)
(c) হাইড্ৰ’জেন (g) + ক্ল’ৰিন (g) → হাইড্ৰ’জেন ক্ল’ৰাইড (g)
(d) মেগনেছিয়াম (s) + হাইড্ৰ’ক্ল’ৰিক এছিড (aq) → মেগনেছিয়াম ক্ল’ৰাইড (aq) + হাইড্ৰ’জেন (g)
উত্তৰ:
|
ক্ৰমিক নং |
সমতুল ৰাসায়নিক সমীকৰণ |
বিক্ৰিয়াৰ প্ৰকাৰ |
|---|---|---|
|
(a) |
2KBr (aq) + BaI2 (aq) → 2KI (aq) + BaBr2 (s) |
দ্বিঅপসৰণ বিক্ৰিয়া |
|
(b) |
ZnCO3 (s) → ZnO (s) + CO2 (g) |
বিযোজন বিক্ৰিয়া |
|
(c) |
H2 (g) + Cl2 (g) → 2HCl (g) |
সংযোজন বিক্ৰিয়া |
|
(d) |
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g) |
অপসৰণ বিক্ৰিয়া |
9. তাপবৰ্জী আৰু তাপগ্ৰাহী বিক্ৰিয়া বুলিলে কি বুজা ? উদাহৰণ দিয়া ।
উত্তৰ: যি ৰাসায়নিক বিক্ৰিয়াত বিক্ৰিয়াজাত পদাৰ্থ উৎপন্ন হোৱাৰ লগতে তাপৰ উদ্ভৱ হয় তাকে তাপবৰ্জী বিক্ৰিয়া বোলে ।
উদাহৰণস্বৰূপে: মিথেন গেছে বায়ুত অক্সিজেনৰ উপস্থিতিত জ্বলি কাৰ্বন ডাই অক্সাইড আৰু পানী উৎপন্ন কৰাৰ লগতে যথেষ্ট পৰিমাণৰ তাপ শক্তি উৎপন্ন কৰে ।
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g) + তাপ শক্তি
আনহাতে ,
যি ৰাসায়নিক বিক্ৰিয়াত শক্তি বা তাপ শোষিত হয় তাকে তাপগ্ৰাহী বিক্ৰিয়া বোলে ।
উদাহৰণস্বৰূপে: ছিলভাৰ ক্ল’ৰাইড আৰু ক্ল’ৰিন সূৰ্যৰ পোহৰৰ উপস্থিতিত ছিলভাৰ উৎপন্ন কৰাৰ লগতে ক্ল’ৰিন উৎপন্ন কৰে ।

10. শ্বসনক এটা তাপবৰ্জী বিক্ৰিয়া বুলি কিয় বিবেচনা কৰা হয় ? বাখ্যা কৰা ।
উত্তৰ: শ্বসন এনে এটা প্ৰক্ৰিয়া য’ত জৈৱিক পদাৰ্থসমূহৰ বিভংগন ঘটি শক্তি মুক্ত হোৱাৰ লগতে সৰল বিক্ৰিয়াজাত পদাৰ্থ উৎপন্ন হয় । যাক পৰৱৰ্তী পৰ্যায়ত দেহৰ বিভিন্ন ক্ৰিয়াকলাপত ব্যৱহাৰ কৰা হয় । পাচন প্ৰক্ৰিয়াত খাদ্যত থকা কাৰ্ব’হাইড্ৰেট গ্লক’জলৈ বিযোজিত হয় । এই গ্লক’জে দেহৰ কোষত অক্সিজেনৰ সৈতে বিকেৰিয়া কৰি কাৰ্বন ডাই অক্সাইড আৰু পানী উৎপন্ন কৰাৰ লগতে শক্তি উৎপন্ন কৰে ।
বিক্ৰিয়াটোৰ ৰাসায়নিক সমীকৰণ হৈছে :-
C6H12O6 (aq) + 6O2 (aq) → 6CO2 (g) + 6H2O (l) + শক্তি
এই বিক্ৰিয়াত শক্তি উতপন্ন হোৱা বাবে ইয়াক তাপবৰ্জী বিক্ৰিয়া হিচাপে বিবেচনা কৰা হয় ।
11. বিযোজন বিক্ৰিয়াক সংযোজন বিক্ৰিয়াৰ বিপৰীত বোলা হয় কিয় ? এই সমূহ বিক্ৰিয়াৰ বাবে সমীকৰণ লিখা ।
উত্তৰ: সংযোজন বিক্ৰিয়াত দুটা বা ততোধিক পদাৰ্থ (মৌল যৌগ) যোজিত হৈ নতুন পদাৰ্থ উৎপন্ন কৰে ।
উদাহৰণস্বৰূপে: অক্সিজেনৰ উপস্থিতিত হাইড্ৰ’জেনক দাহিত কৰিলে ই এক শিখা জ্বলি পানী উৎপন্ন কৰে ।
2H2 (g) + O2 (g) → 2H2 (g)
বিযোজন বিক্ৰিয়াত এটা ৰাসায়নিক পদাৰ্থ বা যৌগ বিযোজিত হৈ দুটা ততোধিক পদাৰ্থ উৎপন্ন হয় ।
উদাহৰণস্বৰূপে: পানীত বিদ্যুত বিশ্লেষণ কৰিলে হাইড্ৰ’জেন গেছ আৰু অক্সিজেন গেছ উৎপন্ন হয় ।

12 . তাপ , পোহৰ আৰু বিদ্যুৎ শক্তিৰে সংঘটিত বিযোজন বিক্ৰিয়াৰ একোটাকৈ সমীকৰণ লিখা ।
উত্তৰ :

13. অপসৰণ আৰু দ্বিঅপসৰণ বিক্ৰিয়াৰ মাজত পাৰ্থক্য কি ? এই বিক্ৰিয়াটোৰ বাবে সমীকৰণ লিখা ।
উত্তৰ: এবিধ ৰাসায়নিক বিক্ৰিয়া য’ত অধিক সক্ৰিয় মৌল এটাই কম সক্ৰিয় মৌল এটাক ইয়াৰ যৌগ দ্ৰৱৰ পৰা অপসাৰিত কৰে তেনে ৰাসায়নিক বিক্ৰিয়াক অপসৰণ বিক্ৰিয়া বোলে ।
যেনে : সমীকৰণ অপসৰণ বিক্ৰিয়াৰ :
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
এবিধ ৰাসায়নিক বিক্ৰিয়া য’ত দুটা বিক্ৰিয়কে আয়ন বিনিময় কৰি নতুন বিক্ৰিয়াজাত পদাৰ্থ উতপন্ন হয় তেনে ৰাসায়নিক বিক্ৰিয়াক দ্বিঅপসৰণ বিক্ৰিয়াৰ বোলে ।
যেনে: সমীকৰণ অপসৰণ বিক্ৰিয়াৰ :
2KBr (aq) + BaI2 (aq) → 2KI (aq) + BaBr2 (s)
14. ছিলভাৰ সংশোধনত ছিলভাৰ নাইট্ৰেট দ্ৰৱ পৰা আহৰণ কৰোঁতে ক’পাৰ ধাতুৰদ্বাৰা অপসাৰণ সংঘটিত কৰা হয় । জড়িত বিক্ৰিয়াটো লিখা ।
উত্তৰ: AgNO3 (aq) + Cu (s) → Cu (NO3)2 (aq) + 2Ag (s)
15. অধ:ক্ষেপণ বিক্ৰিয়া মানে কি বুজা ? উদাহৰণ দি বাখ্যা কৰা ।
উত্তৰ: যি বিক্ৰিয়াৰই অধ:ক্ষেপ উৎপন্ন কৰে (পানীত অদ্ৰৱণীয় গোটা পদাৰ্থ) তাকে অধ:ক্ষেপণ বিক্ৰিয়া বোলে ।
উদাহৰণ: ক’পাৰ ছালফেটৰজলীয় দ্ৰৱৰ মাজেৰে হাইড্ৰ’জেন ছালফাইড গেছ যাব দিলে কপাৰ ছালফাইডৰ এটা ক’লা অধ:ক্ষেপ আৰু ছ’ডিয়াম নাইট্ৰেট দ্ৰৱ উৎপন্ন হয় ।
CuSO4 (aq) + H2S (g) → CuS (s) + H2SO4 (aq)
16. অক্সিজেন লাভ আৰু হেৰুৱা সংজ্ঞাৰে তলৰ পদসমূহ বাখ্যা কৰা ।
(a) জাৰণ ।
(b) বিজাৰণ ।
উত্তৰ: (a) জাৰণ :- যি বিক্ৰিয়াত কোনো এটা পদাৰ্থৰ লগত অক্সিজেন যোগ হয় তাকে জাৰণ বিক্ৰিয়া বোলে ।
উদাহৰণস্বৰূপে: S (s) + O2 (g) → SO2 (g)
ছালফাৰে অক্সিজেন লাভ কৰি ছালফাৰ ডাই অক্সাইড উৎপন্ন কৰে ।
(b) বিজাৰণ :- যি বিক্ৰিয়াত কোনো এটা পদাৰ্থই অক্সিজেন হেৰুৱাই তাকে জাৰণ বিক্ৰিয়া বোলে ।
ZnO (s) + C (g) → Zn (s) + CO (g)
যিংক অক্সাইড ৰ পৰা অক্সিজেন অপসাৰিত হৈছে ।
17. এটা উজ্জল মুগা ৰঙৰ মৌল ‘X’ ক বায়ুত গৰম কৰাত ক’লা হৈ পৰিল । মৌল ‘X’ আৰু উৎপন্ন হোৱা ক’লা ৰঙৰ যৌগটোৰ নাম লিখা ।
উত্তৰ : উজ্জল মুগা ৰঙৰ মৌল ‘X’ হৈছে কপাৰ (Cu) আৰু উৎপন্ন হোৱা ক’লা ৰঙৰ যৌগটো হৈছে ক’পাৰ (II) অক্সাইড (CuO
তলত দিয়া ৰাসায়নিক বিক্ৰিয়াটো সংঘটিত হৈছে :
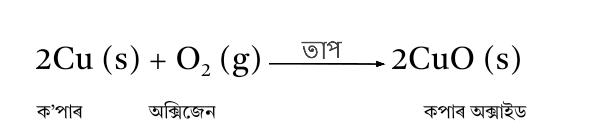
18. লোৰ বস্তুত ৰঙৰ প্ৰলেপ দিও কিয় ?
উত্তৰ: নিয়মীয়া সময়ৰ ব্যৱধানত লোৰ সামগ্ৰীৰ পৃষ্ঠভাগত ৰং প্ৰয়োগৰে মামৰ প্ৰতিৰোধ কৰিব পৰি । লোৰ বস্তুবোৰ বায়ুৰ জলীয় বাষ্পৰ সংস্পৰ্শত লো ফেৰাছ অক্সাইডলৈ জাৰিত হয় যি সংশ্লিষ্ট বস্তুৰ ওপৰত মামৰ বুলি কোবা ৰঙচুৱা মুগা বৰণৰ তৰপ হিচাপে বিৰাজ কৰে । সামগ্ৰীৰ পৃষ্ঠভাগত ৰঙে এক সুৰক্ষা প্রদায়ক প্রলেপ গঠন আ্রৰু এই প্রলেপে ধাতবীয় পৃষ্ঠৰ সৈতে বায়ুৰ আর্দ্রতাৰ সংস্পৰ্শত প্রতিৰোধ কৰি মামৰ সৃষ্টি হোবাত বাধা দিয়ে ।
19. তেল আৰু চৰ্বি থকা খাদ্যবস্তু নাইট্ৰ’জেনৰ পৰিৱেশত পেকেটত ভৰোৱা হয় কিয় ?
উত্তৰ: তেল আৰু চৰ্বি থকা খাদ্যবস্তু নাইট্ৰ’জেনৰ পৰিৱেশত পেকেটত ভৰোৱা হয় কিয়নো নাইট্র’জেনে প্রতিজাৰক হিচাপে কাম কৰে যাৰ ফলত বায়ুৰ অক্সিজেনৰ পৰিৱেশত জাৰণ ঘটিব নোবাৰে । এনেদৰে দুর্গন্ধিতা বা ৰেনচিডিটি প্রতিৰোধ কৰিব পাৰি ।
20. এটা উদাহৰণৰে সৈতে তলৰ পদসমূহ বাখ্যা কৰা ।
(a) ক্ষয়ীভৱন ।
(b) চৰ্বিৰ দুৰ্গন্ধিতা ।
উত্তৰ:
(a) ক্ষয়ীভৱন :- জলীয় বাষ্প , এছিড আদিৰ প্রভাবত ধাতুৰ পৃষ্ঠভাগর অবক্ষয় সাধন হোবা প্রক্রিয়াটোয়েই হৈছে ক্ষয়ীভৱন । ক্ষয়ীভৱন প্রক্রিয়াই ধাতুৰে তৈয়াৰী সকলোবোৰ বস্তু বিশেষকৈ লোৰে তৈয়াৰী বস্তু যেনে – গাড়ী-মটৰ , দলং , জাহাজ আদিৰ ক্ষতিসাধন কৰি জটিল সমস্যাৰ সৃষ্টি কৰে ।
বিভিন্ন ধাতুৰ ওপৰত ক্ষয়ীভৱনৰ কেইটামান প্ৰভাৱ হৈছে :
(i) লোৰ ওপৰত ৰঙচুৱা মুগা বৰণৰ পাউদাৰৰ চামনি পৰে ।
(ii) ছিলভাৰৰ ওপৰত ক’লা চামনি পৰে ।
(iii) কপাৰৰ ওপৰত সেউজীয়া চামনি পৰে ।
উদাহৰণ : লোত মামৰে ধৰাটো সচৰাচৰ পৰিলক্ষিত হোৱা এবিধ ক্ষয়ীভৱন । লোৰ সামগ্ৰীবোৰত বায়ুৰ আৰ্দ্ৰতাৰ সংস্পৰ্শত ৰঙচুৱা মুগা বৰণৰ চামনি পৰে ।
(b) চৰ্বিৰ দুৰ্গন্ধিতা :- তেল অথবা চৰ্বিযুক্ত খাদ্য দীৰ্ঘসময়ৰ কাৰণে ৰাখি থলে বেয়া গোন্ধ তথা বেয়া স্বাদৰ সৃষ্টি হয় । ইয়াৰ কাৰণে এয়েই যে এনে খাদ্য দ্ৰব্যত থকা তেল আৰু চৰ্বি বায়ুৰ অক্সিজেনৰ দ্বাৰা জাৰিত হয় । এই পৰিঘটনাক দুৰ্গন্ধিতা বা ৰেনচিডিটি বুলি কোৱা হয় ।
দুৰ্গন্ধিতা প্ৰতিৰোধ বা মন্থৰ কৰাৰ পদ্ধতিসমূহ :
(i) চৰ্বিযুক্ত বা তেলযুক্ত খাদ্যসমূহত প্ৰতিজাৰক (জাৰণ প্ৰতিৰোধ কৰা দ্ৰৱ্য) যোগ কৰি দুৰ্গন্ধিতা প্ৰতিৰোধ কৰিব পাৰি ।
(ii) বায়ুৰোধী পাত্ৰত ৰখা খাদ্যই জাৰণ প্ৰতিৰোধ কৰে ।
(iii) চৰ্বিযুক্ত বা তেলযুক্ত খাদ্যসমূহত নাইট্ৰ’জেন যোগ কৰা হয় যাতে সেইবোৰ জাৰিত নহয় ।
উদাহৰণ : গ্ৰীষ্মকালত মুকলি ঠাইত ৰখা মাখনত কিছুদিনৰ পাছত গোন্ধ আৰু স্বাদ সলনি হয় ।
SEBA Class 10 Science Chapter 1 – ৰাসায়নিক বিক্ৰিয়া আৰু সমীকৰণ FAQs
Get Free NCERT PDFs
If you want to download free PDFs of any chapter, click the link below and join our WhatsApp group:


Sir important diok